
近日,江苏师范大学石枫、张宇辰等人在轴手性N,N’-双吲哚骨架催化不对称构建领域取得新进展,相关研究成果发表在国际知名期刊Angewandte Chemie International Edition上。江苏师范大学为第一署名单位,我校硕士研究生陈志寒和李天真为论文共同第一作者,石枫教授和张宇辰副教授为共同通讯作者。
导语
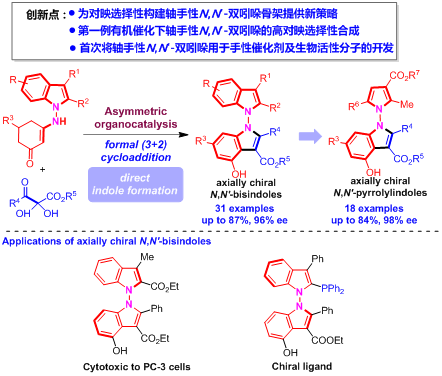
轴手性吲哚骨架存在于众多天然产物、生物活性分子、手性催化剂和配体中,该类骨架的催化不对称构建已经发展成为一个新兴的研究领域。在该领域中,基于吲哚的轴手性五元-六元杂环骨架的催化不对称构建发展非常迅速。与之相比,基于吲哚的轴手性五元-五元杂环骨架的催化不对称构建却发展缓慢,其中,N-N轴手性吲哚骨架的催化不对称构建更是鲜有报道。江苏师范大学石枫、张宇辰等人采用不对称有机催化的策略,实现了轴手性N,N’-双吲哚骨架的高对映选择性构建。他们采用吲哚衍生的烯胺酮作为平台分子,通过催化不对称形式(3+2)环加成策略,合成了结构多样的轴手性N,N’-双吲哚衍生物,并探究了它们在设计新型手性催化剂以及发现生物活性分子中的应用。该工作不仅为轴手性N,N’-双吲哚衍生物的催化不对称合成提供了新策略,而且首次探索了这类骨架在不对称催化及药物化学中的应用前景。
Zhi-Han Chen,+ Tian-Zhen Li,+ Ning-Yi Wang, Xiao-Fang Ma, Shao-Fei Ni, Yu-Chen Zhang* and Feng Shi*, Angew. Chem., Int. Ed. 2023, DOI:10.1002/anie.202300419
正文
轴手性杂环骨架是一类具有独特性质的阻旋异构体,在生物活性分子及手性催化剂开发等领域具有重要的应用价值。因此,轴手性杂环骨架的催化不对称构建受到化学工作者的强烈关注。其中,轴手性吲哚骨架广泛存在于众多天然产物、生物活性分子、手性催化剂之中,这类骨架的催化不对称构建发展地尤为迅速(For a review: Chem. Eur. J. 2020, 26, 15779),江苏师范大学石枫团队在该领域做出了系统性贡献(工作总结:Acc. Chem. Res. 2022, 55, 2562; 代表性工作:Angew. Chem. Int. Ed. 2017, 56, 116; Angew. Chem. Int. Ed. 2019, 58, 3014; Chin. J. Chem. 2020, 38, 543; Angew. Chem. Int. Ed. 2022, 61, e202116829; Fund. Res. 2022, 10.1016/j.fmre.2022.01.002; Chin. J. Chem. 2022, 40, 2151; Sci. China. Chem. 2022, 65, 1929)。
近年来,化学家们通过不对称催化的策略相继构建了结构多样的轴手性吲哚骨架,其中,基于吲哚的轴手性五元-六元杂环骨架的催化不对称构建发展的较为成熟,轴手性N-芳基吲哚、2-芳基吲哚、3-芳基吲哚、3-醌基吲哚、异苯并吡喃酮吲哚等轴手性五元-六元杂环骨架已被成功地构建。然而,与之相比,基于吲哚的轴手性五元-五元杂环骨架的催化不对称构建的研究却非常少,目前仅有几例合成轴手性3,3′-双吲哚、2,3′-双吲哚、吡咯基吲哚的报道(图1a)。这是由于催化不对称构建这类骨架存在诸多挑战性问题,如轴两侧邻位取代基的距离较远、骨架的旋转能垒较低、构型稳定性较弱等。

图1 催化不对称构建轴手性吲哚骨架的概况
轴手性双吲哚骨架是一类重要的基于吲哚的轴手性五元-五元杂环骨架,是许多天然产物、药物活性分子和手性催化剂的核心骨架(图1b)。然而,关于该类化合物催化不对称合成的研究却十分有限,仅有石枫团队通过有机催化策略实现的3,3′-双吲哚骨架的催化不对称构建(Angew. Chem. Int. Ed. 2019, 58, 3014; Chin. J. Chem. 2022, 40, 2151)以及李兴伟课题组在过渡金属催化下实现的2,3′-双吲哚骨架的催化不对称构建(J. Am. Chem. Soc. 2019, 141, 9527)。不仅如此,目前已有的少数例子都局限于C-C轴手性双吲哚骨架的催化不对称构建,N-N轴手性双吲哚骨架的催化不对构建却一直没有实现(图1c)。这一领域主要存在以下挑战性问题:1)实现N-N轴手性的控制;2)发展高效的构建策略;3)探索N-N轴手性双吲哚的潜在应用价值。所以,迫切需要发展催化不对称构建N-N轴手性双吲哚骨架的策略,并探索这类化合物在不对称催化及药物化学中的应用。
自2021年卢一新课题组(Chem 2021, 7, 2743)和刘人荣课题组(J. Am. Chem. Soc. 2021, 143, 15005)分别实现了N-N轴手性骨架的催化不对称构建后,这一领域迅速引起了化学家们的兴趣。目前,这一领域仍然处于起步阶段,催化不对称构建的N-N轴手性骨架仅有1-氨基吲哚、3-氨基喹唑啉酮、双吡咯、酰肼等有限的几类(图2a)。石枫、张宇辰等人于2022年实现了N-N轴手性吡咯-吲哚骨架的催化不对称构建(Angew. Chem. Int. Ed. 2022, 61, e202116829),但这一研究工作并没有解决轴手性N,N'-双吲哚骨架构建中的挑战性问题(图2b),因此,该团队又进一步探索轴手性N,N'-双吲哚骨架的催化不对称构建,并研究此类骨架的潜在应用价值。在研究过程中,刘人荣、李英姿及其合作者(Angew. Chem. Int. Ed. 2022, 61, e202212101)采用钯催化的不对称Buchwald–Hartwig胺化反应,通过分步一锅法的策略实现了轴手性N,N'-双吲哚的催化不对称合成(图2c)。然而,这一领域仍然存在一些迫切需要解决的挑战性问题,如发展催化不对称构建轴手性N,N'-双吲哚骨架的新策略、设计有机催化的不对称反应构建轴手性N,N'-双吲哚骨架、探索轴手性N,N'-双吲哚骨架的潜在应用价值等。
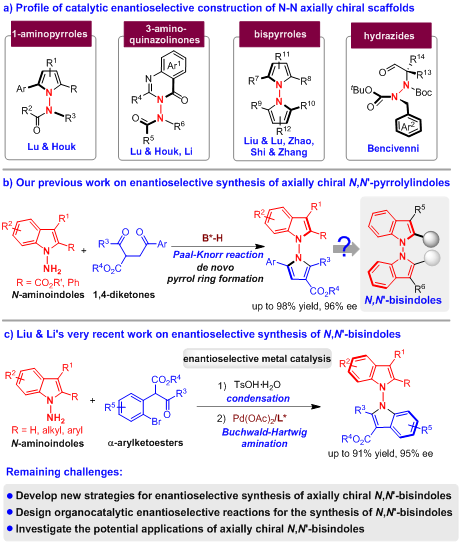
图2 催化不对称构建轴手性N,N'-双吲哚骨架的策略及挑战性问题
为了解决这些挑战性问题,石枫、张宇辰等人希望发展有机催化的不对称反应合成轴手性N,N'-双吲哚,并研究此类化合物的潜在应用价值。该团队将环状烯胺酮作为官能团引入到N-氨基吲哚中,设计了吲哚衍生的烯胺酮这类平台分子,希望通过此类平台分子参与的有机催化下不对称环化反应构建吲哚环(图3a)。在该设计中,烯胺酮片段是不对称有机催化的反应位点及活化位点,吲哚衍生的烯胺酮作为1,3-双亲核试剂与1,2-双亲电试剂发生有机催化的不对称(3+2)环加成反应,从而直接形成另外一个吲哚环,实现轴手性N,N'-双吲哚骨架的催化不对称构建。虽然该设计具有很高的可行性,但是在实施该策略的过程中,仍有一些关键问题需要解决,如寻找可用于直接构建吲哚环的1,2-双亲电试剂,选择适合的有机催化剂控制反应的区域及对映选择性等。
为了实现这一目标,作者设计了有机催化下吲哚衍生的烯胺酮与2,3-二酮酯的不对称形式(3+2)环加成反应(图3b)。采用2,3-二酮酯作为1,2-双亲电试剂,是基于2,3-二酮酯两个羰基具有极高的亲电性。选择手性磷酸作为合适的有机催化剂,是由于手性磷酸易于与两种反应物的氨基和羰基形成氢键,从而能够控制反应的活性及对映选择性。在此反应中,吲哚衍生的烯胺酮中烯烃的亲核性比氨基强,2,3-二酮酯中α-羰基比β-羰基活性高,这使得两次亲核加成反应能够有序进行,从而确保了反应区域选择性的有效控制。两次亲核加成之后的脱水过程以及芳构化作用将促使新吲哚环的形成,最终可以实现轴手性N,N'-双吲哚骨架的催化不对称构建。
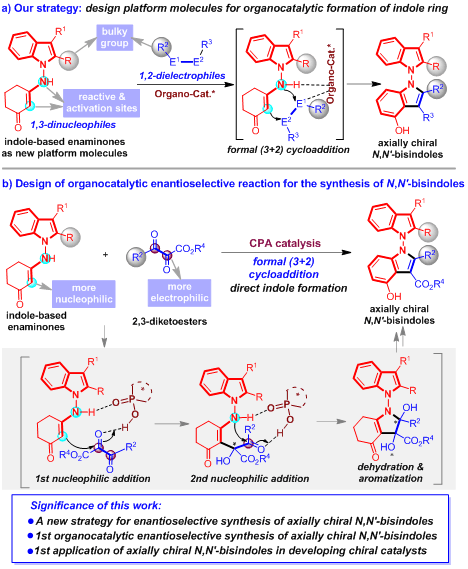
图3 催化不对称构建N,N'-双吲哚骨架的设计
因此,该工作不仅将首次通过有机催化的策略实现轴手性N,N'-双吲哚骨架的不对称构建,同时还将首次探索N,N'-双吲哚衍生物在催化剂开发及药物研发中的应用。
基于上述策略,作者采用吲哚衍生的烯胺酮1a与2,3-二酮酯前体2a作为反应物,进行反应条件优化,最终以87%的产率和93% ee得到轴手性N,N'-双吲哚衍生物3aa(图4)。
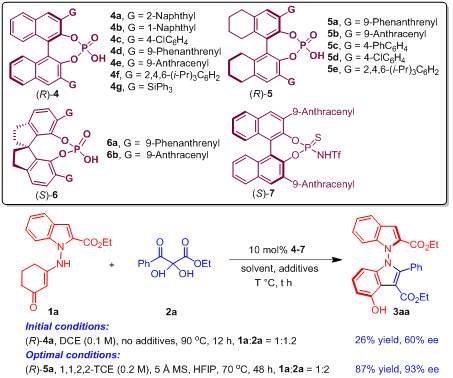
图4 反应条件的优化
确定了反应的最优条件之后,作者考察了底物的适用范围,发现含不同取代基的吲哚衍生烯胺酮1及2,3-二酮酯前体2都能适用于该反应,可以高收率、高对映选择性地得到结构多样的轴手性N,N'-双吲哚衍生物3(图5)。
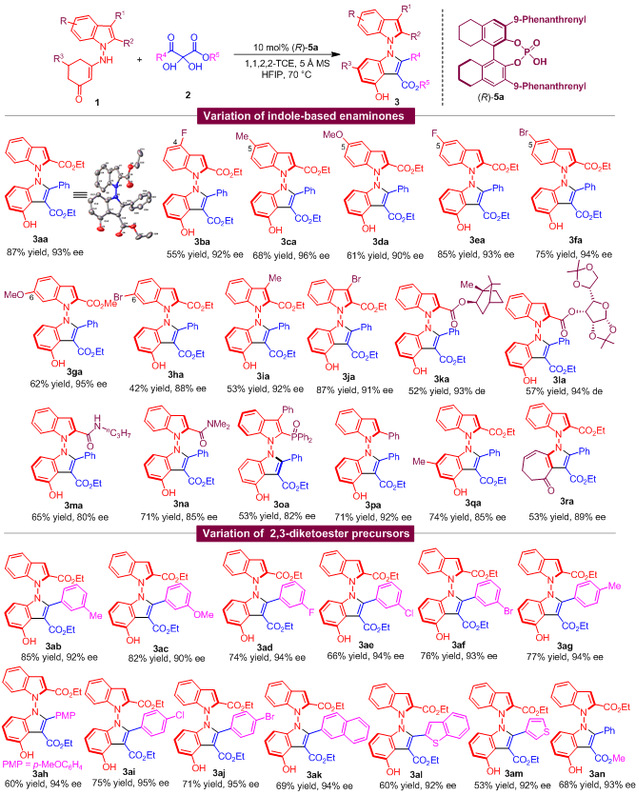
图5 合成轴手性N,N'-双吲哚衍生物的底物适用范围
作者在之前的研究中,基于N-氨基吲哚与1,4-二酮衍生物的催化不对称Paal-Knorr反应原位构建了吲哚环,实现了轴手性N,N'-吡咯吲哚骨架的高对映选择性构建。在这个工作中,作者尝试了吡咯衍生的烯胺酮与2,3-二酮酯的不对称形式(3+2)环加成反应,希望为轴手性N,N'-吡咯吲哚骨架的催化不对称构建提供新的策略(图6)。
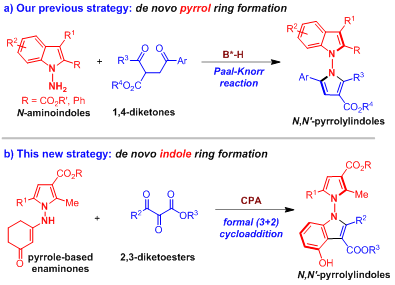
图6 催化不对称构建轴手性N,N'-吡咯吲哚骨架的两种策略对比
作者在合成轴手性N,N'-双吲哚衍生物的最优条件下,尝试了此反应(图7)。含不同取代基的吡咯衍生烯胺酮8及2,3-二酮酯前体2都能很好适用于此(3+2)环加成反应,高收率、高对映选择性地得到结构多样的轴手性N,N'-吡咯吲哚衍生物9。
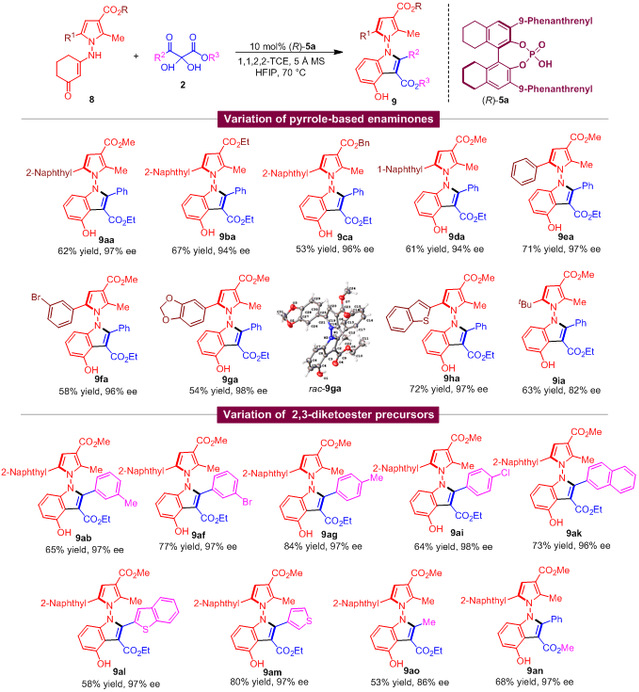
图7 合成轴手性N,N'-吡咯吲哚衍生物的底物适用范围
随后,作者提出了可能的反应机理(图8),2,3-二酮酯前体2脱水形成2,3-二酮酯2’,手性磷酸通过氢键作用活化烯胺酮1或8以及2,3-二酮酯2’,促使二者经历两次不对称亲核取代反应得到中间体B,随后经过两次脱水过程以及芳构化过程最终得到N-N轴手性吲哚衍生物3或9。

图8 可能的反应机理
为了深入了解N-N轴手性吲哚衍生物的性质以及研究该形式(3+2)环加成反应的实用性,作者进行了产物稳定性研究、放大量实验、三组分实验、产物抗肿瘤活性研究。作者发现轴手性N,N'-双吲哚衍生物3aa及轴手性N,N'-吡咯吲哚衍生物9aa在150 ℃下搅拌10小时后,能够以接近定量的收率回收,并且对映选择性保持不变,这表明该类轴手性骨架具有很高的化学稳定性和构型稳定性(图9a)。此外,计算发现,3aa和9aa具有较高的旋转能垒。作者随后进行了1 mmol规模放大量实验,反应结果与0.1mmol规模相似(图9b)。此外,作者还进行了N-氨基吲哚10或N-氨基吡咯12、环己酮11a、2,3-二酮酯前体2的三组分实验,反应均能以中等的产率和优异的对映选择性得到相应的产物(图9c)。最后,为了探究该类N,N'-双吲哚衍生物可能的生物活性,作者对部分产物进行了抗肿瘤活性筛选,发现一些化合物对PC-3肿瘤细胞具有较好的细胞毒活性(图9d)。
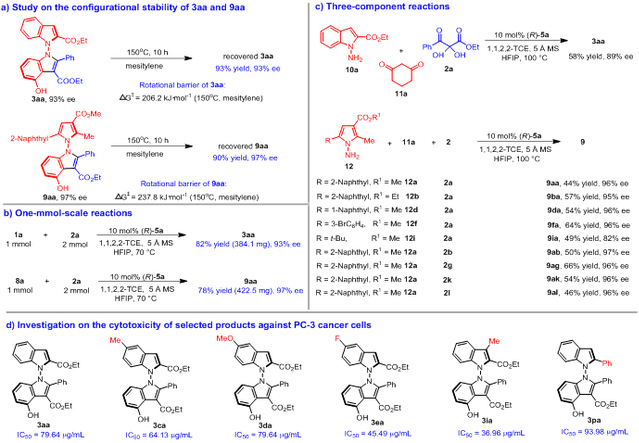
图9 产物稳定性、放大量实验、三组分实验及抗肿瘤活性研究
为了进一步研究产物的用途,作者进行了多种衍生化实验,均获得了优良的收率,对映选择性也均能保持(图10a)。此外,作者还探索了这两类N-N轴手性吲哚衍生物在不对称催化中的应用价值。作者将产物3oa转化成手性膦配体24,此类手性配体在烯丙基碳酸酯25与丙二酸二乙酯26的催化不对称烯丙基化反应中表现出了很好的对映选择性控制能力(图10b)。此外,作者将产物9aa转化成N-N轴手性叔胺-酰胺催化剂28,并将其应用于噻唑亚胺29与高肽酸酐30的不对称(2+4)环化反应,获得了中等的对映选择性。这些结果表明这两类N-N轴手性吲哚衍生物在手性催化剂及配体开发中具有较为广阔的应用前景。
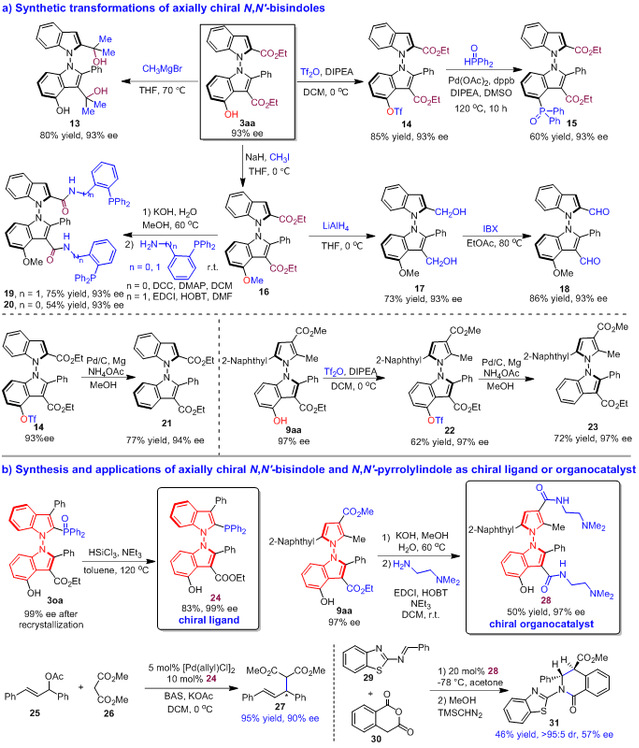
图10 产物的合成转化及作为催化剂、配体的应用
综上所述,江苏师范大学石枫、张宇辰等人首次基于有机催化的策略实现了轴手性N,N'-双吲哚骨架的高对映选择性构建。他们设计了吲哚及吡咯衍生的烯胺酮作为新型平台分子,采用催化不对称形式(3+2)环加成反应,高效、高对映选择性地合成了结构多样的N-N轴手性吲哚衍生物,并发现了一些具有较好抗肿瘤活性的化合物。此外,作者还将合成的N-N轴手性吲哚衍生物转化成手性催化剂及配体,并应用于催化不对称合成中。该工作不仅为高对映选择性构建N,N'-双吲哚骨架提供了新策略,同时还首次探索了这类化合物在不对称催化及药物化学中的应用,解决了N-N轴手性双吲哚骨架催化不对称构建及应用研究中的挑战性问题。



